ПРАВИТЕЛЬСТВО
РОССИЙСКОЙ ФЕДЕРАЦИИ
ПОСТАНОВЛЕНИЕ
от 31 октября
2020 г. N 1771
ОБ УТВЕРЖДЕНИИ
ОСОБЕННОСТЕЙ
ГОСУДАРСТВЕННОГО
РЕГУЛИРОВАНИЯ ПРЕДЕЛЬНЫХ ОТПУСКНЫХ ЦЕН
ПРОИЗВОДИТЕЛЕЙ НА
ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, ВКЛЮЧЕННЫЕ
В ПЕРЕЧЕНЬ
ЖИЗНЕННО НЕОБХОДИМЫХ И ВАЖНЕЙШИХ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, И
ВНЕСЕНИИ ИЗМЕНЕНИЙ В ОТДЕЛЬНЫЕ АКТЫ
ПРАВИТЕЛЬСТВА
РОССИЙСКОЙ ФЕДЕРАЦИИ
В соответствии с частью 9 статьи 61 Федерального закона
"Об обращении лекарственных средств" Правительство Российской
Федерации постановляет:
1. Утвердить прилагаемые:
особенности государственного регулирования
предельных отпускных цен производителей на лекарственные препараты, включенные
в перечень жизненно необходимых и важнейших лекарственных препаратов;
изменения, которые вносятся в акты Правительства
Российской Федерации.
2. Настоящее постановление вступает в силу
со дня его официального опубликования.
Председатель
Правительства
Российской
Федерации
М.МИШУСТИН
Утверждены
постановлением
Правительства
Российской
Федерации
от 31 октября 2020
г. N 1771
ОСОБЕННОСТИ
ГОСУДАРСТВЕННОГО
РЕГУЛИРОВАНИЯ ПРЕДЕЛЬНЫХ ОТПУСКНЫХ ЦЕН
ПРОИЗВОДИТЕЛЕЙ НА
ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ, ВКЛЮЧЕННЫЕ
В ПЕРЕЧЕНЬ
ЖИЗНЕННО НЕОБХОДИМЫХ И ВАЖНЕЙШИХ
ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ
1. Настоящий документ определяет особенности
государственного регулирования предельных отпускных цен производителей на
лекарственные препараты, включенные в перечень жизненно необходимых и важнейших
лекарственных препаратов (далее соответственно - предельная отпускная цена,
лекарственные препараты), в случае дефектуры или риска возникновения дефектуры
лекарственных препаратов в связи с ценообразованием на них.
2. Федеральная служба по
надзору в сфере здравоохранения проводит на основании поступающей от субъектов
обращения лекарственных средств для медицинского применения информации
мониторинг дефектуры (рисков ее возникновения) либо отсутствия в обращении
лекарственных препаратов в связи с ценообразованием на них.
При выявлении дефектуры (рисков ее
возникновения) Федеральная служба по надзору в сфере здравоохранения формирует
на основании сведений и информации согласно приложениям N 1 - 3 заключение о
дефектуре (риске ее возникновения) либо об отсутствии в обращении лекарственных
препаратов в связи с ценообразованием на них по утверждаемой Федеральной
службой по надзору в сфере здравоохранения форме (далее - заключение) и
представляет его в Министерство здравоохранения Российской Федерации.
3. На наличие дефектуры (рисков ее
возникновения) может указывать снижение индекса отклонения поступления
лекарственного препарата в гражданский оборот в Российской Федерации (Иоткл)
менее чем на минус 30 процентов, рассчитанного по формуле:
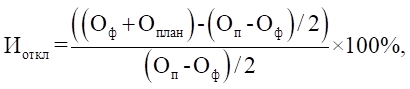
где:
Оф - количество лекарственных
форм лекарственных препаратов, отнесенных к одному международному
непатентованному (или химическому, или группировочному) наименованию и имеющих
одинаковый путь введения (эквивалентные лекарственные формы и дозировки),
введенных в гражданский оборот в Российской Федерации за 6 месяцев,
предшествующих месяцу формирования заключения;
Оплан - количество лекарственных
форм лекарственных препаратов, отнесенных к одному международному непатентованному
(или химическому, или группировочному) наименованию и имеющих одинаковый путь
введения (эквивалентные лекарственные формы и дозировки), которое планируется
ввести в гражданский оборот в Российской Федерации в последующие 6 месяцев,
согласно сведениям, представленным в соответствии с пунктом 4 настоящего
документа;
Оп - количество лекарственных
форм лекарственных препаратов, отнесенных к одному международному
непатентованному (или химическому, или группировочному) наименованию и имеющих
одинаковый путь введения (эквивалентные лекарственные формы и дозировки),
введенных в гражданский оборот в Российской Федерации за 30 месяцев,
предшествующих месяцу формирования заключения.
В случае если все лекарственные препараты,
отнесенные к одному международному непатентованному (или химическому, или
группировочному) наименованию и имеющие одинаковый путь введения (эквивалентные
лекарственные формы и дозировки), имеют одинаковое общее количество
лекарственных форм во вторичной (потребительской) упаковке, допускается
осуществлять расчет показателей Оф, Оплан и Оп
в потребительских упаковках.
4. Для подготовки
заключения Федеральная служба по надзору в сфере здравоохранения запрашивает в
машиночитаемом виде (формате) у:
держателей или владельцев регистрационных
удостоверений лекарственных препаратов (уполномоченных ими лиц), отнесенных к
одному международному непатентованному (или химическому, или группировочному)
наименованию и имеющих одинаковый путь введения (эквивалентные лекарственные
формы и дозировки), сведения о планируемом объеме ввода в гражданский оборот в
Российской Федерации лекарственных препаратов по форме в соответствии с приложением
N 2 к настоящему документу посредством личного кабинета в автоматизированной
информационной системе Федеральной службы по надзору в сфере здравоохранения;
федерального государственного бюджетного
учреждения "Центр экспертизы и контроля качества медицинской помощи"
Министерства здравоохранения Российской Федерации информацию о наличии
лекарственных препаратов в клинических рекомендациях, стандартах медицинской
помощи или мероприятиях по иммунопрофилактике и о возможности (невозможности)
их замены по форме в соответствии с приложением N 3 к настоящему документу;
Министерства здравоохранения Российской
Федерации и Министерства промышленности и торговли Российской Федерации
имеющиеся сведения о дефектуре (рисках ее возникновения) либо об отсутствии в
обращении лекарственных препаратов в связи с ценообразованием на них.
Представление запрашиваемых сведений и
информации осуществляется в течение 10 рабочих дней со дня направления запроса
Федеральной службы по надзору в сфере здравоохранения.
5. Министерство
здравоохранения Российской Федерации не позднее 5 рабочих дней со дня
поступления заключения размещает в личном кабинете держателя или владельца
регистрационного удостоверения лекарственного препарата (уполномоченного им
лица), указанного в заключении (далее - заявитель), на своем официальном сайте
в информационно-телекоммуникационной сети "Интернет" на портале по
ведению государственного реестра лекарственных средств в личном кабинете (далее
- личный кабинет) заявителя предложение о перерегистрации предельной отпускной
цены на лекарственный препарат в соответствии с настоящим документом.
6. При поступлении
предложения, указанного в пункте 5 настоящего документа, заявитель в течение 10
рабочих дней со дня поступления такого предложения размещает в личном кабинете
следующие документы и сведения в электронном виде:
а) заявление о перерегистрации предельной
отпускной цены на лекарственный препарат с указанием предлагаемой к
перерегистрации предельной отпускной цены на лекарственный препарат;
б) расчет предлагаемой к перерегистрации
предельной отпускной цены на лекарственный препарат с приложением обосновывающих
документов, подтверждающих необходимость перерегистрации предельной отпускной
цены на лекарственный препарат;
в) расчет предельной отпускной цены на
лекарственный препарат в соответствии с приложением N 3 к методике расчета
предельных отпускных цен производителей на лекарственные препараты, включенные
в перечень жизненно необходимых и важнейших лекарственных препаратов,
утвержденной постановлением Правительства Российской Федерации от 15 сентября
2015 г. N 979 "О внесении изменений в постановление Правительства
Российской Федерации от 29 октября 2010 г. N 865 и об утверждении методики
расчета предельных отпускных цен производителей на лекарственные препараты,
включенные в перечень жизненно необходимых и важнейших лекарственных препаратов"
(далее - методика).
7. Министерство
здравоохранения Российской Федерации осуществляет проверку полноты документов и
сведений, поступивших в соответствии с пунктом 6 настоящего документа, в срок,
не превышающий 10 рабочих дней со дня их поступления, перенаправляет их
посредством системы электронного межведомственного взаимодействия в
машиночитаемом виде (формате) в Федеральную антимонопольную службу с
приложением заключения, документов, сведений и информации, указанных в пункте 2
настоящего документа, для осуществления экономического анализа заявленной к
перерегистрации предельной отпускной цены на лекарственный препарат.
8. В случае необходимости уточнения и (или)
дополнения документов и сведений, указанных в пункте 6 настоящего документа,
заявитель представляет по запросу Министерства здравоохранения Российской
Федерации соответствующую информацию посредством размещения ее в личном
кабинете с одновременным уведомлением Министерства здравоохранения Российской
Федерации о размещении такой информации соответствующим письмом в адрес
Министерства здравоохранения Российской Федерации.
Срок представления ответа на запрос
заявителем не может превышать 10 рабочих дней со дня размещения Министерством
здравоохранения Российской Федерации запроса в личном кабинете.
При этом общий срок
рассмотрения документов и сведений Министерством не может превышать 20 рабочих
дней.
При непоступлении от заявителя в
установленный срок запрашиваемых документов и сведений Министерство
здравоохранения Российской Федерации в течение 5 рабочих дней со дня истечения
срока, указанного в абзаце третьем настоящего пункта, принимает решение об
отказе в перерегистрации предельной отпускной цены на лекарственный препарат, о
чем уведомляет заявителя посредством размещения соответствующей информации в
личном кабинете.
9. Федеральная антимонопольная служба в
течение 10 рабочих дней со дня поступления документов, указанных в пунктах 6 и 7
настоящего документа, проводит экономический анализ заявленной к
перерегистрации предельной отпускной цены на лекарственный препарат, в том числе
с учетом минимальных отпускных цен в иностранных государствах на лекарственные
препараты, отнесенные к одному международному непатентованному (или
химическому, или группировочному) наименованию и имеющие одинаковый путь
введения (эквивалентные лекарственные формы и дозировки), и представляет в
Министерство здравоохранения Российской Федерации решение о согласовании
перерегистрации предельной отпускной цены на лекарственный препарат или решение
об отказе в согласовании перерегистрации предельной отпускной цены на
лекарственный препарат (с изложением причин отказа).
10. В случае необходимости уточнения и
(или) дополнения документов и сведений, указанных в пункте 6 настоящего
документа, Министерство здравоохранения Российской Федерации, Министерство
промышленности и торговли Российской Федерации, Федеральная служба по надзору в
сфере здравоохранения, заявитель, субъекты обращения лекарственных средств для
медицинского применения представляют по запросу Федеральной антимонопольной
службы запрашиваемые ею документы и сведения.
Срок представления запрашиваемых документов
и сведений не может превышать 10 рабочих дней со дня направления запроса
Федеральной антимонопольной службой.
При этом общий срок
рассмотрения документов и сведений Федеральной антимонопольной службой не может
превышать 20 рабочих дней.
11. При непоступлении в установленный срок
запрошенных у заявителя документов и сведений Федеральная антимонопольная
служба в течение 5 рабочих дней со дня истечения срока, указанного в абзаце
третьем пункта 10 настоящего документа, принимает решение об отказе в
согласовании перерегистрации предельной отпускной цены на лекарственный
препарат и направляет его в Министерство здравоохранения Российской Федерации.
12. Основаниями для отказа в согласовании
Федеральной антимонопольной службой перерегистрации предельной отпускной цены
на лекарственный препарат являются:
а) представление заявителем недостоверных
сведений в целях перерегистрации предельной отпускной цены на лекарственный
препарат в соответствии с настоящим документом;
б) непредставление заявителем ответа на
запрос Федеральной антимонопольной службы, либо представление запрошенных
документов и сведений в неполном объеме, либо представление недостоверных
сведений;
в) экономическая необоснованность
представленной для перерегистрации предельной отпускной цены на лекарственный
препарат, выявленная по результатам экономического анализа.
13. Министерство здравоохранения Российской
Федерации в течение 5 рабочих дней со дня получения:
а) решения Федеральной антимонопольной
службы о согласовании перерегистрации предельной отпускной цены на
лекарственный препарат издает приказ Министерства о перерегистрации предельной
отпускной цены на лекарственный препарат, действующий один год с даты его
издания, вносит соответствующие данные в государственный реестр предельных
отпускных цен производителей на лекарственные препараты, включенные в перечень
жизненно необходимых и важнейших лекарственных препаратов (далее соответственно
- приказ о перерегистрации цены, государственный реестр), размещает в личном
кабинете заявителя выписку из приказа о перерегистрации цены и размещает
соответствующую информацию на своем официальном сайте в
информационно-телекоммуникационной сети "Интернет" на портале по
ведению государственного реестра лекарственных средств;
б) решения Федеральной антимонопольной
службы об отказе в согласовании перерегистрации предельной отпускной цены на
лекарственный препарат принимает решение об отказе в перерегистрации предельной
отпускной цены на лекарственный препарат и в течение 5 рабочих дней уведомляет
заявителя в личном кабинете о принятом решении с изложением причин отказа и
приложением решения Федеральной антимонопольной службы.
14. Основаниями для отказа в
перерегистрации Министерством здравоохранения Российской Федерации предельной
отпускной цены на лекарственный препарат являются:
а) неполнота представленных заявителем в
соответствии с пунктом 6 настоящего документа документов и сведений;
б) непредставление заявителем ответа на
запрос Министерства здравоохранения Российской Федерации, либо представление
необходимых сведений в неполном объеме, либо представление недостоверных
сведений;
в) размещение в личном кабинете документов
и сведений в соответствии с пунктом 6 настоящего документа заявителем, которому
не поступало предложение в соответствии с пунктом 5 настоящего документа;
г) размещение заявителем в личном кабинете
документов и сведений с нарушением срока, предусмотренного абзацем первым
пункта 6 настоящего документа;
д) решение Федеральной антимонопольной
службы об отказе в согласовании перерегистрации предельной отпускной цены на
лекарственный препарат.
15. Федеральная
антимонопольная служба проводит экономический анализ перерегистрированных в
соответствии с настоящим документом цен на лекарственные препараты в течение
срока действия приказа о перерегистрации цены в иностранных государствах,
указанных в приложении N 2 к методике.
16. В случае выявления по
результатам экономического анализа превышения перерегистрированной в
соответствии с настоящим документом предельной отпускной цены над минимальными
отпускными ценами производителей лекарственных препаратов, отнесенных к одному
международному непатентованному (или химическому, или группировочному)
наименованию и имеющих одинаковый путь введения (эквивалентные лекарственные
формы и дозировки), в 3 и более иностранных государствах, указанных в
приложении N 2 к методике, Федеральная антимонопольная служба в течение 5
рабочих дней со дня выявления такого факта информирует об этом держателя или
владельца регистрационного удостоверения лекарственного препарата
(уполномоченное им лицо) и не позднее чем за 5 рабочих дней до истечения срока
действия приказа о перерегистрации цены направляет в Министерство
здравоохранения Российской Федерации решение о снижении перерегистрированной в
соответствии с настоящим документом предельной отпускной цены на лекарственный
препарат.
Перерегистрированная в соответствии с
настоящим документом предельная отпускная цена на лекарственный препарат
подлежит снижению до минимальной отпускной цены в иностранных государствах,
рассчитанной в соответствии с разделом VII методики по среднему курсу
соответствующей иностранной валюты к рублю Российской Федерации, установленному
Центральным банком Российской Федерации за 3 календарных месяца, предшествующие
месяцу проведения экономического анализа, предусмотренного настоящим пунктом,
но не ниже цены, применявшейся до вступления в силу приказа о перерегистрации
цены.
17. Если по результатам
экономического анализа, указанного в пункте 15 настоящего документа,
Федеральной антимонопольной службой не выявлено превышения перерегистрированной
в соответствии с настоящим документом предельной отпускной цены на
лекарственный препарат над минимальными отпускными ценами производителей
лекарственных препаратов, отнесенных к одному международному непатентованному
(или химическому, или группировочному) наименованию и имеющих одинаковый путь
введения (эквивалентные лекарственные формы и дозировки), в 3 и более
иностранных государствах, указанных в приложении N 2 к методике, Федеральная
антимонопольная служба не позднее чем за 5 рабочих дней до истечения срока
действия приказа о перерегистрации цены представляет в Министерство
здравоохранения Российской Федерации решение о подтверждении предельной отпускной
цены на лекарственный препарат.
18. Министерство здравоохранения Российской
Федерации в течение 5 рабочих дней со дня поступления решений Федеральной
антимонопольной службы, предусмотренных абзацем первым пункта 16 и пунктом 17
настоящего документа, издает приказы о перерегистрации цены, вносит
соответствующие данные в государственный реестр и размещает в личном кабинете
заявителя выписку из приказа о перерегистрации цены.
19. В случае перерегистрации предельной
отпускной цены на лекарственный препарат в соответствии с настоящим документом
цена на лекарственный препарат не может быть заявлена для перерегистрации в
целях увеличения в соответствии с пунктом 30 Правил государственной регистрации
и перерегистрации предельных отпускных цен производителей на лекарственные
препараты, включенные в перечень жизненно необходимых и важнейших лекарственных
препаратов, утвержденных постановлением Правительства Российской Федерации от
29 октября 2010 г. N 865 "О государственном регулировании цен на
лекарственные препараты, включенные в перечень жизненно необходимых и важнейших
лекарственных препаратов", в течение одного года со дня издания приказа о
перерегистрации цены.
20. Федеральная
антимонопольная служба отменяет решение о согласовании перерегистрации
предельной отпускной цены в случае, если после вступления в силу приказа о
перерегистрации цены установлено, что заявителем в Федеральную антимонопольную
службу представлены недостоверные сведения, повлиявшие на результат принятого
решения о согласовании перерегистрации предельной отпускной цены на
лекарственный препарат и (или) не представлены сведения, которые могли повлиять
на результат такого решения.
21. Министерство здравоохранения Российской
Федерации отменяет решение о перерегистрации предельной отпускной цены на
лекарственный препарат, принятое в соответствии с настоящим документом, в
случае, если после принятия такого решения установлено, что заявителем
представлены недостоверные сведения, повлиявшие на результат принятого
Министерством здравоохранения Российской Федерации решения, и в случае, если
Федеральная антимонопольная служба отменила решение о согласовании
перерегистрации предельной отпускной цены на лекарственный препарат на
основании пункта 20 настоящего документа, и устанавливает цену на лекарственный
препарат, действовавшую до вступления в силу приказа о перерегистрации цены, а
также вносит соответствующие изменения в государственный реестр.
22. Лекарственные препараты, реализованные
производителями по цене, действовавшей до вступления в силу приказа о
перерегистрации цены, могут находиться в гражданском обороте по указанной цене
с учетом установленных к ней предельных размеров оптовых и розничных надбавок
до истечения срока их годности.
Приложение N 1
к особенностям
государственного
регулирования
предельных отпускных цен
производителей на
лекарственные
препараты,
включенные в перечень
жизненно
необходимых и важнейших
лекарственных
препаратов
(форма)
|
(заполняется
Федеральной службой по надзору в сфере здравоохранения)
|
|
СВЕДЕНИЯ
о
лекарственных препаратах, поступивших в гражданский оборот в Российской
Федерации
|
|
Международное
непатентованное наименование
|
Наименование
производителя, номер регистрационного удостоверения
|
Торговое
наименование
|
Лекарственная
форма, дозировка, форма выпуска
|
Зарегистрированная
предельная отпускная цена, рублей, без налога на добавленную стоимость
|
Количество
упаковок, поступивших в гражданский оборот в Российской Федерации за 30
месяцев, предшествующих дате начала проведения мониторинга дефектуры
|
|
1 - 6
предшествующих месяцев
|
7 - 18
предшествующих месяцев
|
19 - 30
предшествующих месяцев
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Итого
|
|
|
|
|
Исполнитель
|
|
|
|
|
|
|
|
|
|
(должность)
|
|
(подпись)
|
|
(расшифровка
подписи)
|
|
Дата составления документа "__" _____ 20__
г.
|
Приложение N 2
к особенностям
государственного
регулирования
предельных отпускных цен
производителей на
лекарственные
препараты,
включенные в перечень
жизненно
необходимых и важнейших
лекарственных
препаратов
(форма)
|
|
В Федеральную службу по надзору в сфере
здравоохранения
|
|
СВЕДЕНИЯ
о планируемом
объеме ввода лекарственного препарата в гражданский оборот в Российской
Федерации
|
|
|
|
(наименование
держателя или владельца регистрационного удостоверения лекарственного
препарата)
|
|
Международное
непатентованное наименование
|
Держатель или
владелец регистрационного удостоверения лекарственного препарата,
производитель, номер регистрационного удостоверения
|
Торговое
наименование
|
Лекарственная
форма, дозировка, форма выпуска
|
Зарегистрированная
предельная отпускная цена, рублей, без налога на добавленную стоимость
|
Планируемый
объем ввода в гражданский оборот в Российской Федерации в последующие 12
месяцев при текущей зарегистрированной предельной отпускной цене
производителя, количество упаковок
|
Запрашиваемая
держателем или владельцем регистрационного удостоверения лекарственного
препарата предельная отпускная цена производителя
|
Планируемый
объем ввода в гражданский оборот в Российской Федерации в последующие 12
месяцев при установлении запрашиваемой предельной отпускной цены
производителя, количество упаковок
|
|
с 1 - 6 месяц
|
с 7 - 12 месяц
|
с 1 - 6 месяц
|
с 7 - 12 месяц
|
|
|
|
|
|
|
|
|
|
|
|
|
Исполнитель
|
|
|
|
|
|
|
|
|
|
(должность)
|
|
(подпись)
|
|
(расшифровка
подписи)
|
|
Дата составления документа "__" ________
20__ г.
|
Приложение N 3
к особенностям
государственного
регулирования
предельных отпускных цен
производителей на
лекарственные
препараты,
включенные в перечень
жизненно
необходимых и важнейших
лекарственных
препаратов
(форма)
|
|
В Федеральную службу по надзору в сфере
здравоохранения от федерального государственного бюджетного учреждения
"Центр экспертизы и контроля качества медицинской помощи"
Министерства здравоохранения Российской Федерации
|
|
Информация
о наличии
лекарственных препаратов в клинических рекомендациях, стандартах медицинской
помощи или мероприятиях по иммунопрофилактике и о возможности (невозможности)
их замены
|
|
Международное
непатентованное наименование
|
Наименование
производителя, номер регистрационного удостоверения
|
Торговое
наименование
|
Лекарственная
форма, дозировка, форма выпуска
|
Зарегистрированная
предельная отпускная цена, рублей, без налога на добавленную стоимость
|
Информация о
наличии лекарственного препарата в клинических рекомендациях, стандартах
медицинской помощи или мероприятиях по иммунопрофилактике (да, нет)
|
Возможность
замены (да/нет) (в случае возможности замены указывается препарат замены)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Исполнитель
|
|
|
|
|
|
|
|
|
|
(должность)
|
|
(подпись)
|
|
(расшифровка
подписи)
|
|
Дата составления документа "__" ________
20__ г.
|
Утверждены
постановлением
Правительства
Российской
Федерации
от 31 октября 2020
г. N 1771
ИЗМЕНЕНИЯ,
КОТОРЫЕ ВНОСЯТСЯ
В ОТДЕЛЬНЫЕ АКТЫ ПРАВИТЕЛЬСТВА
РОССИЙСКОЙ
ФЕДЕРАЦИИ
1. В постановлении Правительства Российской Федерации от 29
октября 2010 г. N 865 "О государственном регулировании цен на
лекарственные препараты, включенные в перечень жизненно необходимых и важнейших
лекарственных препаратов" (Собрание законодательства Российской Федерации,
2010, N 45, ст. 5851; 2011, N 50, ст. 7390; 2012, N 37, ст. 5002; 2015, N 37,
ст. 5153; N 38, ст. 5302; 2018, N 43, ст. 6597; 2019, N 51, ст. 7649):
а) в Правилах государственной регистрации и
перерегистрации предельных отпускных цен производителей на лекарственные
препараты, включенные в перечень жизненно необходимых и важнейших лекарственных
препаратов, утвержденных указанным постановлением:
подпункт "г" пункта 32, абзац
первый пункта 34, абзац четвертый подпункта "а" и абзац четвертый
подпункта "б" пункта 35 и пункт 37 после слов "последней
перерегистрации" дополнить словами ", обязательной перерегистрации в
2019 - 2020 годах";
дополнить пунктом 38(1) следующего
содержания:
"38(1). При наличии в отношении одного
лекарственного препарата решения Министерства здравоохранения Российской
Федерации о перерегистрации зарегистрированной предельной отпускной цены
производителя на лекарственный препарат в соответствии с пунктом 30 настоящих
Правил либо в соответствии с пунктом 38 настоящих Правил и решения Министерства
здравоохранения Российской Федерации об обязательной перерегистрации в 2019 -
2020 годах предельной отпускной цены производителя в соответствии с Правилами
обязательной перерегистрации в 2019 - 2020 годах зарегистрированных предельных
отпускных цен производителей на лекарственные препараты, включенные в перечень
жизненно необходимых и важнейших лекарственных препаратов, утвержденными
постановлением Правительства Российской Федерации от 29 октября 2010 г. N 865
"О государственном регулировании цен на лекарственные препараты,
включенные в перечень жизненно необходимых и важнейших лекарственных
препаратов", применению подлежит цена, перерегистрированная в соответствии
с пунктом 30 либо пунктом 38 настоящих Правил.";
б) абзац второй пункта 39 Правил
обязательной перерегистрации в 2019 - 2020 годах зарегистрированных предельных
отпускных цен производителей на лекарственные препараты, включенные в перечень
жизненно необходимых и важнейших лекарственных препаратов, утвержденных
указанным постановлением, после слов "предельная отпускная цена"
дополнить словами "для одного или нескольких производителей
(производственных площадок производителя), указанных в рамках одного
регистрационного удостоверения,".
2. В методике расчета предельных отпускных
цен производителей на лекарственные препараты, включенные в перечень жизненно
необходимых и важнейших лекарственных препаратов, утвержденной постановлением
Правительства Российской Федерации от 15 сентября 2015 г. N 979 "О внесении
изменений в постановление Правительства Российской Федерации от 29 октября 2010
г. N 865 и об утверждении методики расчета предельных отпускных цен
производителей на лекарственные препараты, включенные в перечень жизненно
необходимых и важнейших лекарственных препаратов" (Собрание
законодательства Российской Федерации, 2015, N 38, ст. 5302; 2018, N 43, ст.
6597; 2019, N 51, ст. 7649):
а) подпункт "б" пункта 3 изложить
в следующей редакции:
"б) в случае если лекарственный
препарат иностранного производства или производителя государства - члена
Евразийского экономического союза реализуется в иностранных государствах, в
отношении которых представляется информация об уровне минимальных отпускных цен
на лекарственные препараты согласно приложению N 2, - минимальную отпускную
цену производителя (без учета производственных площадок) на лекарственный
препарат в указанных государствах, рассчитанную в соответствии с разделом VII
настоящей методики на основании расчета предельной отпускной цены производителя
на лекарственный препарат, представляемой на государственную регистрацию
(перерегистрацию), согласно приложению N 3 с учетом расходов, связанных с
таможенным оформлением.";
б) подпункт "в" пункта 10
изложить в следующей редакции:
"в) в случае если лекарственный
препарат иностранного производства или производителя государства - члена
Евразийского экономического союза реализуется в иностранных государствах, в
отношении которых представляется информация об уровне минимальных отпускных цен
на лекарственные препараты, указанных в приложение N 2 к настоящей методике, -
минимальную отпускную цену производителя (без учета производственных площадок)
на лекарственный препарат в указанных государствах, рассчитанную в соответствии
с разделом VII настоящей методики на основании расчета предельной отпускной
цены производителя на лекарственный препарат, представляемой на государственную
регистрацию (перерегистрацию), предусмотренного приложением N 3 к настоящей
методике, с учетом расходов, связанных с таможенным оформлением.".